Werkingsprincipe van de batterij
Hoe werken een wandklok, een afstandsbediening van een tv of een radiografisch kinderspeelgoed? De meeste mensen zullen zonder aarzeling antwoorden “uit batterijen” en in principe zullen ze gelijk hebben. Maar het is onwaarschijnlijk dat een van hen zal kunnen vertellen hoe de draagbare batterij precies is verdrievoudigd, hoe deze functioneert, en zonder welke het hele proces van het overbrengen van elektrische stroom van de batterij naar de eindgebruiker onmogelijk zou zijn. Laten we deze vervelende leemte in kennis opvullen.
De inhoud van het artikel
Werkingsprincipe van de batterij
Om het werkingsprincipe van een conventionele AA-batterij te begrijpen, moet u een algemeen begrip van de structuur ervan hebben. Elke batterij bestaat dus uit drie hoofdelementen: anode, kathode en elektrolyt. Bovendien kunnen deze laatste vrijwel elke aggregatietoestand hebben: de kathode en anode geplaatst in een zoutoplossing zijn in principe ook een ‘batterij’, alleen in een vorm die ongebruikelijk is voor de gemiddelde mens.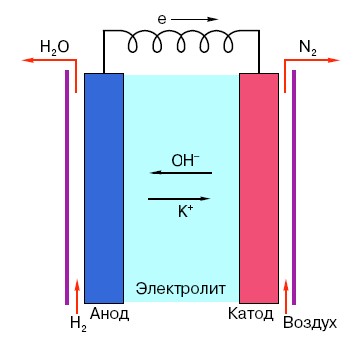
Interessant! De zogenaamde “voltaïsche kolom”, uitgevonden door Alessandro Volta, beschikte ook over alle elementen die nodig zijn voor de productie van elektrische stroom. Het bestond uit op elkaar gestapelde zink- en koperplaten, waartussen een in zuur gedrenkte doek als “laag” werd gelegd.
De anode in dergelijke systemen is de belangrijkste bron van elektronen, die, zoals we weten uit een natuurkundecursus op school, een negatieve lading hebben.Negatief geladen deeltjes worden aangetrokken door positieve deeltjes, en in dit geval fungeert het kathodeoppervlak als een “pluspunt”.
Maar dit is niet genoeg om een elektrische stroom te laten ontstaan, omdat elektronen ook een soort ‘snelweg’ nodig hebben – een medium dat de interactie van de kathode en anode zou ondersteunen. Het is hier dat een elektrolyt “op het podium” verschijnt: een zout, alkali of zuur dat stroom kan geleiden.
Laten we het werkingsprincipe bekijken aan de hand van een specifiek voorbeeld: er is een batterij met een vermogen van 18 volt. De spanning tussen de elektroden erin is stabiel totdat deze op het netwerk is aangesloten. Zodra een consument verschijnt (bijvoorbeeld een gewone gloeilamp), begint de spanning geleidelijk af te nemen, begint de stroom van de "negatieve" elektrode naar de "positieve" elektrode te stromen en vindt er een chemische reactie plaats in de elektrolyt gericht op het potentiaalverschil tussen de elektroden behouden.
Referentie. Hoe meer energie de consument nodig heeft, hoe intenser de reactie in de batterij en hoe sneller deze kapot gaat.
Hoe een oplaadbare batterij werkt, hoe deze verschilt van een gewone batterij
We hebben dus gekeken naar de klassieke “vinger”- en “pink”-batterijen en we weten dat de levensduur van de meeste ervan strikt beperkt is (ongeacht wat beroemde fabrikanten zeggen). Maar hoe zit het met de zogenaamde batterijen - batterijen van het batterijtype die niet alleen energie kunnen verbruiken tijdens het reactieproces, maar deze ook kunnen accumuleren en lange tijd kunnen opslaan?
Om het werkingsprincipe van de batterij te begrijpen, is het noodzakelijk om zich tot de chemie te wenden. Laten we als voorbeeld nemen... Een gewoon houtskoolvuur.Hoe mooi en fascinerend de vlam er ook uitziet, elke scheikundige die hem observeert, weet dat dit proces slechts een langdurige reactie is van brandstofoxidatie. Het verbranden van steenkool heeft een wisselwerking met zuurstof en als resultaat van deze reactie krijgen we:
- kooldioxide;
- licht;
- warm.
En als de laatste twee punten de ziel en het lichaam kunnen verwarmen, dan kunnen we kooldioxide op geen enkele manier gebruiken, omdat het een bijproduct is van de reactie, dat in feite het afval ervan is. De oxidatiereactie stopt wanneer de startelementen: zuurstof en steenkool opraken. Het stoppen van de reactie in een batterij gebeurt op precies dezelfde manier als de uitgangsstoffen volledig zijn uitgeput en er alleen nog ‘afval’ overblijft.
In de batterij gebeurt alles een beetje anders. Feit is dat de reactie die daarin optreedt tot de categorie omkeerbaar behoort, dat wil zeggen dat hij onder bepaalde omstandigheden kan worden "omgekeerd", waardoor alle stoffen in hun oorspronkelijke staat worden teruggebracht. Het is de mogelijkheid dat er een omkeerbare reactie in de batterij optreedt waardoor deze kan worden opgeladen.
In een batterij die op het netwerk is aangesloten, verloopt de reactie in de tegenovergestelde richting en vloeit de stroom van "plus" naar "min", en niet andersom. Als gevolg hiervan vormt het reactieproduct de uitgangsstoffen en ontvangt de eigenaar van de batterij beschikbare “teruggewonnen” energie in een draagbaar formaat. Dat is alles!





